Une carte complète des connexions cérébrales, le connectome, est nécessaire pour interpréter les mesures des signaux transmis entre les neurones. Dans le cerveau humain, ces signaux circulent dans un réseau complexe de dizaines de milliards de neurones, dont chacun est relié à 10 000 autres, via les axones qui constituent les faisceaux de fibres de la matière blanche. Identifier ces voies de connexions est une première approche pour établir une telle carte. Une autre approche, dite de connectivité fonctionnelle, est de suivre l’activité spontanée synchronisée entre les groupes de neurones.
La combinaison de ces deux approches est possible grâce aux avancées de l’imagerie par résonance magnétique (IRM) anatomique et fonctionnelle. Notre projet entre dans le cadre de cette nouvelle discipline de la neuroscience moderne, la connectomique, qui examine l’organisation anatomique et le fonctionnement du cerveau à travers le connectome pour la mettre en relation avec le fonctionnement cognitif.
- Connectome structurel : L. Petit (contact)
- Connectivité intrinsèque : M. Joliot (contact), Ginesis Lab
Décrire la structure du connectome humain…
Tout d’abord, le connectome est principalement structurel, basé sur un ensemble très étendu mais fini de liens physiques entre les éléments neuronaux que sont les axones. Cette réalité physique de la connectivité structurelle est accessible avec l’imagerie par résonance magnétique de diffusion (dMRI) et la tractographie à haute résolution.
L’IRM de diffusion reflète la diffusion aléatoire des molécules d’eau, qui est affectée par la structure microscopique du tissu, ici le cerveau humain, et permet d’étudier la microarchitecture de ces tissus en termes de densité et d’organisation structurelle. Le signal de diffusion des molécules d’eau au sein d’une structure de la matière blanche très compacte et très bien rangée dans une seule direction comme le corps calleux est très différent de celui mesuré dans la matière grise où l’eau diffuse plus librement. En outre, les faisceaux d’axones de matière blanche entravent les mouvements de l’eau perpendiculaires à leur axe d’orientation et cet effet peut être suivi de place en place pour estimer les voies de passages de ces longs faisceaux de matière blanche, c’est ce qu’on entend par tractographie.
La tractographie pondérée par diffusion est à l’heure actuelle le seul outil non invasif disponible pour obtenir des informations sur l’architecture neurale de la matière blanche du cerveau humain. Il est ainsi possible de représenter in vivo sous la forme de fibres virtuelles représentant chacune plusieurs milliers voire dizaines de milliers d’axones le réseau tridimensionnel des connexions anatomiques entre les différentes régions du cerveau. Ce réseau extrêmement enchevêtré mais très organisé, appelé tractogramme, est constitué des faisceaux de fibres de matières blanches tels que les ont définis les neuroanatomistes par dissection post-mortem depuis le 19e siècle. Mais tout comme ces derniers, il convient de mettre en place une méthodologie spécifique afin d’extraire ces différents faisceaux et de mieux appréhender cette connectivité structurelle.

Encart 1. Aperçu de la dissection virtuelle du faisceau fronto-occipital inférieur (IFOF) et du faisceau unciné (UF) avec la méthode “stem-based”.
Dans la première étape, nous avons retiré du tractogramme complet (A): les fibres inférieures à 10 mm, celles limités à la matière grise corticale et celles dites « en-U » se maintenant dans la matière blanche superficielle. Nous avons également supprimé les fibres traversant le cervelet et le tronc cérébral ainsi que les fibres du corps calleux car elles n’appartiennent pas, par définition, aux faisceaux d’association. Dans l’étape suivante, l’élimination des fibres en-U avec des terminaisons dans l’insula et le pôle temporal découvre le stem de l’IFOF (B, en haut), tandis que le retrait de ces fibres se terminant dans l’insula et le gyrus temporal supérieur révèle le stem de l’UF (B, en bas). Une fois que le stem exposé, une région d’intérêt est manuellement dessinée autour du stem, tout comme le neuroanatomiste isole la même structure avec une languette de papier lors de la dissection post-mortem (C).
Pour répondre à cela nous combinons les approches issues de la dissection post-mortem et les méthodes d’extraction automatiques afin d’identifier l’ensemble des voies de connexions des fibres de matière blanche sur de larges cohortes de sujets comme la BIL&GIN et MRi-Share.Nous avons ainsi mis au point une méthode de dissection virtuelle des faisceaux de fibres de la matière blanche en reproduisant au plus près les gestes du neuroanatomiste lorsqu’il dissèque ces mêmes faisceaux post-mortem (Hau et al. 2016a,b). Il s’agit d’identifier la zone de convergence où toutes les fibres d’un même faisceau passent. Appliquée à l’étude du faisceau fronto-occipital inférieur (IFOF) et du faisceau unciné (UF) (Encart 1), validé par dissection post-mortem en collaboration avec S. Sarubbo (Structural and Functional Connectivity Lab (SFC-Lab), Trento, Italie), cette méthode a permis de décrire la carte des terminaisons corticales de ces faisceaux avec une bien meilleure précision que ce qui est habituellement documenté. La qualité des tractogrammes sur lesquels nous réalisons ces dissections virtuelles est également primordiale. Nous bénéficions à cet égard des meilleurs outils actuels grâce à notre collaboration avec le Sherbrooke Imaging Connectivity Lab (SCIL) dirigé par le Professeur M. Descoteaux, reconnu internationalement pour ces travaux en sur la tractographie.
… en relation avec le fonctionnement cognitif.
Si l’IRM de diffusion et la tractographie mettent en lumière l’organisation structurelle du cerveau, l’organisation fonctionnelle est l’objet de l’étude de la connectivité intrinsèque. Toujours en utilisant l’IRM, il est possible d’enregistrer les variations de concentration de la déoxy-hémoglobine contenu dans le sang, on parle alors d’IRM fonctionnelle (IRMf) ou d’imagerie en contraste BOLD (« Blood oxygen level dependant »). Les variations de BOLD interviennent majoritairement dans la matière grise, à savoir dans les régions corticales et les noyaux gris, points de départs ou d’arriver des faisceaux de fibres branches. Bien connues depuis l’avènement de l’imagerie hémodynamique dans les années 1980, ces variations sont le marqueur du fonctionnement des réseaux de régions cérébrales supportant la cognition, car elles indexent directement (en tomographie par émission de positons, TEP) ou indirectement (en IRMf) l’augmentation de débit sanguin cérébrale consécutive à l’activation d’une région donnée. Dans les années 2000, en utilisant la technique de TEP nous avons été une des premières équipes (Mazoyer et al., 2001) avec l’équipe américaine de Marcus Raichle à St Louis aux Etats Unis à mettre en évidence que certaines régions du cerveau montrent un mode de fonctionnement par défaut sans qu’une tâche cognitive donnée ne soit nécessaire à leur activation. Cette activité intrinsèque est ainsi observée lorsqu’un sujet est à l’état de repos, qu’il laisse aller ses pensées. Par la suite le développement de l’IRMf, notamment par sa capacité à enregistrer la dynamique du signal, a alors permis de démontrer qu’il existe une activité dite « de repos » dans l’ensemble de la matière grise, sous la forme de variations oscillatoires très lentes du signal BOLD de l’ordre d’une oscillation toutes les 20 à 100 secondes. Ce phénomène, décrit comme des fluctuations spontanées, a la propriété d’être synchronisé sur des ensembles de régions plus ou moins éloignées. Ces régions synchrones sont ainsi considérées comme fonctionnellement connectées entre-elles et constituent un réseau fonctionnel lié à l’activité intrinsèque du cerveau à l’état de repos. On distingue ainsi différents réseaux fonctionnels dont chacun présente une activité spontanée spécifique. L’ensemble de ces réseaux de connectivité intrinsèque constitue enfin une parcellation fonctionnelle du cerveau dont l’identification et l’étude de sa variabilité sont à la base de nos travaux (Doucet 2011, 2012 ; Naveau 2012.

Encart 2. Exemples de réseaux fonctionnels de la connectivité intrinsèque. Parcellation fonctionnelle du cerveau à partir de 29 réseaux de connectivité intrinsèque extraits par l’algorithme MICCA (Naveau et al. 2012). Analyse réalisée à partir des acquisitions en IRMf de 282 sujets à l’état de repos. Ces sujets appartiennent à la base de données BIL&GIN. 1. vue antérieure et latérale gauche présentant 5 réseaux essentiellement constitués de régions du lobe frontal ; 2 à 5. vues supérieures et latérales gauches montrant respectivement les réseaux sensori-moteurs, fronto-temporo-pariétaux et ceux du mode de fonctionnement par défaut ; 6. Vue postérieure et latérale gauche illustrant les réseaux centrés sur les aires auditives et visuelles.
Ces réseaux de la connectivité intrinsèque, dit du repos, ressemblent fortement aux réseaux décrits comme supportant les fonctions cognitives. En d’autres termes, la grande majorité des réseaux fonctionnels identifiés en TEP et IRMf à l’aide de tâches cognitives données, comme le réseau de l’orientation de l’attention spatiale, ceux du langage ou de l’action sont semblables aux réseaux fonctionnels observés au repos. Il est donc possible sur la base d’une simple acquisition de données en IRMf d’une dizaine de minutes d’identifier l’ensemble des réseaux fonctionnels d’un sujet alors qu’il ne réalise aucune tâche cognitive particulière.
Jusqu’à quel niveau de précision la connectivité intrinsèque observée au repos peut être prédictive de l’organisation fonctionnelle de la cognition humaine ?
Les enjeux sont importants, car imaginons qu’il soit possible d’inférer l’intégrité du fonctionnement cognitif à partir d’un seul examen de repos ; les conséquences dépasseraient le cadre de la recherche en neurosciences pour investir celui de la médecine, en aidant au diagnostique en neurologie dans le cas où un ou plusieurs réseaux montreraient une organisation différente et/ou dégradée voire des cas où le réseau n’existerait plus. L’étude présentée dans l’encart ci-dessous est une étape de cette démonstration, elle nous a permis de mettre en évidence qu’il existe au niveau des réseaux de connectivité intrinsèque une trace de l’organisation asymétrique atypique des individus dont la spécialisation hémisphérique pour le langage est inversée par rapport à la population générale.
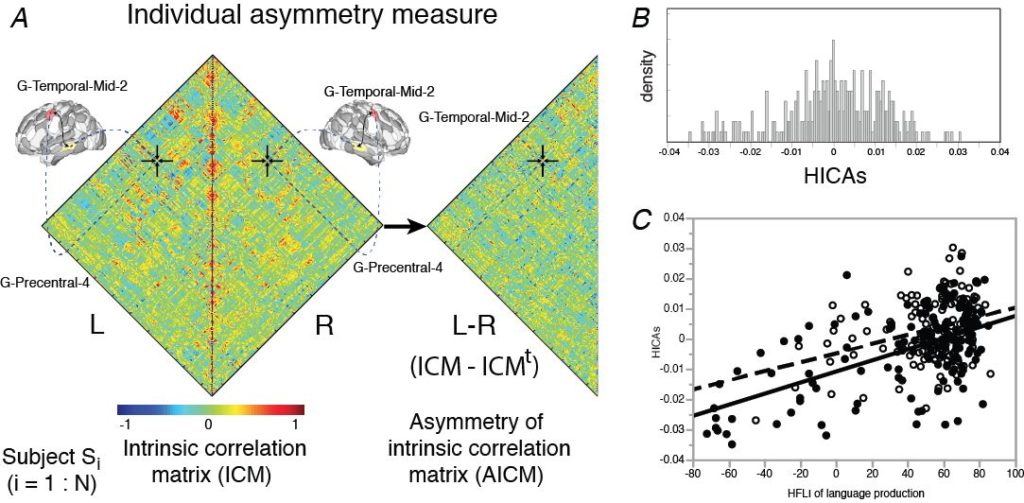
La matrice de connectivité intrinsèque de chaque région de l’atlas AICHA* a été calculée au sein d’un même hémisphère et pour chacun des 289 sujets à partir de leurs acquisitions en IRMf à l’état de repos (BIL&GIN, Mazoyer et al. 2016). Une matrice d’asymétrie de ces corrélations intra-hémisphériques (AICM) a ensuite été dérivée par soustraction des matrices des hémisphères gauche et droit.
Pour chaque sujet, un index de similarité de ces asymétries de connectivité intrinsèque (HICAS) a été défini en comparant sa matrice asymétrique (AICM) à celle des 288 autres sujets. Le graphe montre ici la distribution de ces index HICAS pour les 289 sujets.
Nous avons observé une corrélation linéaire positive et significative entre les index HICAS et les index de latéralisation hémisphérique fonctionnelle (HFLI) mesuré lors d’une tâche de production de phrases, avec un effet de la préférence manuelle. Nous avons notamment observée que les sujets gauchers présentant une asymétrie atypique droite pour une tâche de langage (HFLI < -50) présentent une asymétrie de connectivité intrinsèque droite la plus importante (HICAS < -0.02) (gauchers en noir, droitiers en blanc).
* L’atlas AICHA (Joliot et al. 2015) est un atlas du cerveau décrivant les aires homotopes de connectivité intrinsèque. Chaque région AICHA d’un hémisphère est appariée avec son homotope dans l’autre hémisphérique par le fait que l’activité spontanée à l’état de repos entre ces deux régions est plus fortement corrélée que pour le reste du cerveau.
Étudier le connectome du cerveau humain requiert à la fois de s’intéresser à la connectivité anatomique et à la connectivité fonctionnelle. D’un point de vue général, nous savons que l’activité intrinsèque du cerveau et les différentes fonctions cognitives associées sont nécessairement contraintes par la connectivité anatomique sous-jacente, bien que les relations précises entre ces deux formes de connectivités soit encore loin d’être claires. Notre objectif est ainsi de combler le fossé entre structure et fonction et comprendre comment le vaste répertoire des états fonctionnels du cerveau humain peut émerger de sa structure anatomique.
